Hoy me he levantado con ganas de liarla, voy a aumentar la entropía para poner un poco de desorden en el trabajo y voy a mandar un correo de esos que… espera un momento, ¿entropía? ¿pero que palabra es esa? ¡Deja de inventarte palabras que para eso están los de letras!
En realidad no me estoy inventando ninguna palabra, aunque si puede que la esté empleando mal, pero vamos a empezar por el principio, no sea que aumentemos más la entropía :o)
En nuestro día a día estamos acostumbrados a encontrarnos con situaciones que ocurren en un determinado sentido y no en otro. Cuando un huevo se cae de la mesa, vemos que se rompe y tenemos que limpiar el suelo. En ningún momento vemos como el huevo, se recompone y vuelve por si solo a la mesa, cosa que estaría bien para evitar el tener que limpiar el suelo. Este es el ejemplo clásico (siempre he querido ponerlo como ejemplo) pero hay muchos otros, como cuando abrimos una lata de refresco y vemos que el gas se escapa, nunca vemos como vuelve al interior de la lata, cuando ponemos un cubito de hielo en un vaso y éste se funde nunca se vuelve a convertir en cubito, o cuando en un ordenador con sistema operativo Windows te aparece el mensaje de “ha ocurrido un error inesperado y el programa se cerrará”, nunca se vuelve a abrir el sólo y puede incluso que tengas que tirar el ordenador y buscar otro sistema operativo más fiable.
Todos estos procesos son denominados procesos irreversibles, es decir sólo pueden progresar en un cierto sentido, o lo que es lo mismo, evolucionan sólo en un sentido.
A mediados del siglo XIX, Rudolf Julius Emmanuel Clausius, Clausius para los que nos complicó la vida en las clases de Termodinámica, se propuso encontrar una magnitud que cuantificara la tendencia de los sistemas a realizar un cambio determinado y que verificara en que sentido se realizaba es cambio. Ya que era alemán se lo ocurrió introducir la palabra griega ετυροπη que significa evolución, y que ha llegado hasta nuestros días como entropía y que representamos con la letra S. La entropía, como magnitud Física, es una medida de la capacidad para que se realice el cambio, tal y como Clausius pretendía. Es una propiedad intrínseca de la materia y su magnitud depende únicamente de la naturaleza del cuerpo considerado y del estado en que se encuentre.
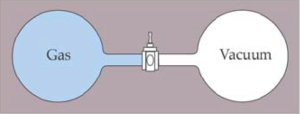
Pongamos un ejemplo más sencillo de entender que el del huevo que se cae, y para ello vamos a considerar un experimento clásico, a la vez que sencillo, que es conocido con el nombre de experimento de Joule o expansión libre.
En este experimento Joule, introdujo un gas en un recinto que estaba unido a otro recinto en el que se había hecho un vacío. El sistema completo está aislado del exterior por lo que no puede intercambiar ningún tipo de energía en forma de calor. Los dos recintos están separados por una válvula cerrada. Cuando la válvula se abre el gas se expande hacia el recinto que está vacío hasta ocupar el volumen total de los dos recintos. Si ahora nos ponemos a esperar hasta que el gas vuelve a estar en el recinto inicial y en el otro se queda el vacío también, puede que perdamos el tiempo y nos hagamos viejos, porque es el proceso de expansión es irreversible. ¿Qué ha pasado aquí? Lo más obvio es que el gas que antes ocupaba un volumen pequeño, llamémosle V1, ahora ha pasado a ocupar un volumen mayor V2. Si calculásemos matemáticamente la entropía del sistema de recintos más los alrededores (recordemos que el sistema está aislado y no intercambia energía en forma de calor), veríamos que si restamos la entropía que había antes de abrir la válvula y la entropía que hay después, esta diferencia es mayor que cero, es decir la entropía ha aumentado.
Lo mismo ocurre en el caso del huevo que se cae, la entropía del universo (entendido este como el huevo más la mesa, más el suelo, más el aire entre la mesa y el suelo) aumenta.
En este punto y sin haber escrito todavía ninguna fórmula, me parece que no ha quedado claro que es la entropía. Y no es para menos porque la entropía es una de las ideas de la ciencia que más difícil ha sido de comprender por muchos estudiantes, y puede que por muchos profesores que la intentan explicar, así que si la habéis entendido, ¡por favor explicádmela!
Vamos a darle un poco la vuelta. Hasta ahora hemos estado en el mundo macroscópico, pero nos vamos a meter en la nave de El Chip Prodigioso para irnos al mundo microscópico a ver si nos aclaramos. Una vez nos han miniaturizado hasta ser del tamaño de una molécula de gas, nos metemos en el recinto que contiene el gas del experimento de Joule y esperamos a que abran la válvula. Mientras esperamos, como estamos aburridos, contamos las moléculas de gas que hay en el recinto y vemos, que como el recinto es muy pequeño y el gas es caro, Joule sólo ha podido comprar 10 moléculas. Ahora se abre la válvula. ¿Qué es lo que vemos? Empezamos viendo que una molécula se va al recinto en el que había un vacío, luego se va otra, luego nos vamos nosotros y detrás se vienen las demás menos una. Una vez estamos en el otro recinto, de repente vemos que una molécula se vuelve al recinto inicial, después otra y todas las demás quedándonos solos. Pero por poco tiempo, porque un rato después tres moléculas vuelven a hacernos compañía hasta que una de ellas decide volverse al otro recinto… podría seguir así, pero me estoy cansando de escribir, así que imaginaos como sigue.
¿Qué es lo que ha pasado aquí? Hemos dicho que el experimento de Joule ponía de manifiesto la irreversibilidad del proceso, pero a escala microscópica hemos estado muy cerca que el proceso fuera reversible, es decir, de que todas las moléculas volvieran al recinto inicial (hemos faltado nosotros). ¿Cómo puede ser eso? A nivel macroscópico hay muchas cosas que no vemos y que se nos escapan. A nivel microscópico existe una probabilidad de que todas las partículas estén en el mismo estado, que disminuye según aumenta el número de partículas, es decir el número de estados posibles aumenta (para no liarnos, y aunque NO es del todo cierto, vamos a asimilar el concepto de estado a estar en un recinto o en otro). A medida que el número de estados posibles aumenta, también aumenta el desorden del sistema, es decir como cada molécula está en un estado diferente, estará haciendo lo que le venga en gana sin tener en cuenta a las demás, aumentando el desorden del sistema. La entropía, a nivel microscópico depende de este número de estados posibles distintos, por lo que a mayor número de estados, mayor entropía. Pero como hemos dicho a mayor número de estados, mayor desorden y por lo tanto concluimos que la entropía es una medida del desorden del sistema.
Aunque la entropía viene de la palabra griega evolución, si que la estaba utilizando bien al principio ya que tiene que ver con el desorden, y como mande el correo que tengo en la cabeza, ¡voy a poner todo patas arriba!
Referencias
Paul A. Tipler. Física. Editorial Reverte.
José Aguilar Peris. Curso de Termodinámica. Alhambra Longman

Entonces el tiempo tiene su propia entropía.
La entropía y el tiempo están relacionados de manera que de una manera ‘romántica’ se dice que la entropía es la flecha del tiempo. La evolución de un sistema en el tiempo viene dada por la entropía.
Es decir que el la entropía ocurre al interior del tiempo.
Que la entropía aumente implica que no sepuede volver hacia atrás (el huevo se cae, se rompe y no vuelve a la mesa entero de manera espontánea). En el universo la entropia siempre aumenta al mismo tiempo que el tiempo va hacia adelante. Puede haber sistemas aislados donde la entropía sea nula (no haya desorden) pero eso no significa que se detenga el tiempo. En ciero modo, se podría entender como dices, solo que la entropia y el tiempo son magnitudes relacionadas pero que no contienen la una a la otra.
Sí, como magnitudes no se ve esa relación.